2024年10月11日
アミロイドベータの悪玉化機構を解明 -アルツハイマー病の複数の新規創薬標的も発見-
概 要
長崎大学大学院医歯薬学総合研究科ゲノム創薬学分野の岩田修永教授と理化学研究所(理研)脳神経科学研究センター神経老化制御研究チームの西道隆臣チームリーダーらの国際共同研究グループは、アルツハイマー病(AD)[1]の脳内でアミロイドベータ(Aβ)[2]が分解されにくい「悪玉」に変化する仕組みを解明しました。
アルツハイマー病の脳にたまってアミロイド斑を作るAβの大半はピログルAβ[3]と呼ばれる悪玉Aβですが、生理的に産生するAβからこの悪玉Aβに変化する仕組みは分かっていませんでした。
今回の研究で、遺伝子操作により、Aβを分解する酵素であるネプリライシン[4]を働かないようにしたアルツハイマー病のモデルマウス[5]を解析したところ、通常では働かない別の酵素(エキソペプチダーゼ[6])が増えてネプリライシンの代わりにAβを分解するようになりました。その過程で分解に抵抗するような「飾り」がAβに付けられてそれ以上分解が進まなくなり、悪玉Aβがどんどんたまるようになることが分かりました。この飾りはピログルタミル化、飾りを付ける酵素はグルタミン酸環化酵素[7]と呼ばれます。
アルツハイマー病の予防や治療のために、今後は、ネプリライシンの活性が低下しないように維持する薬、ネプリライシンの代わりに働くアミノペプチダーゼやジペプチジルペプチダーゼ、さらにピログルタミル化を行うグルタミン酸環化酵素の働きを抑える薬の開発が、新しい方法として期待されます。
本研究は、科学雑誌『Life Science Alliance』のオンライン版(9月30日付)に掲載されました。
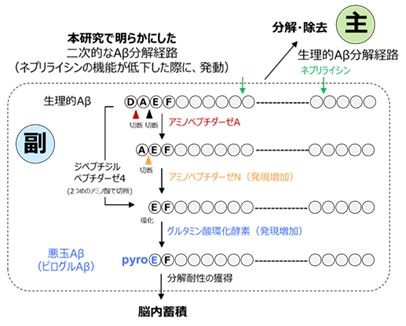 悪玉Aβが作られる仕組み |
背 景
アミロイドベータ(Aβ)が脳内に大量にたまると、脳の環境が変化して、神経細胞が正常に働かなくなったり壊されたりしてしまい、認知機能や記憶能力が障害を受けます。これが、アルツハイマー病(AD)です。Aβは正常な脳でも作られます(正常な脳で作られるAβをここでは生理的Aβと呼びます)。生理的Aβは、アミノ末端がアスパラギン酸から始まる全長40または42個のアミノ酸から成るAβで、通常はネプリライシンによって分解除去されています。年齢を重ねるとネプリライシンを作り出す脳の力が衰えますが、特にAD患者の脳ではこの力が極端に弱くなりAβが壊されず正常老化脳以上にたまるようになります。
ADの脳でたまるアミロイド斑に含まれるAβのアミノ末端構造を調べると、神経細胞が作る生理的Aβとは異なり、最初の二つのアミノ酸が切断され、三つ目のアミノ酸(グルタミン酸)が環状構造に変換されたピログルAβと呼ばれる悪玉Aβが多いことが報告されていました。また、ピログルAβは、最近、米国に続いて日本でも認可された早期AD治療薬の抗体医薬ドナネマブ[8]の標的Aβとしても知られるようになりました。しかしピログルAβの高い凝集性(塊を作る能力)のために、ピログルAβがどれくらい脳の中にたまっているのかを知るための定量的な解析は進んでいませんでした。また、Aβが変化してピログルAβとしてたまるようになるのはなぜか、どのような仕組みでピログルAβが作られるのかも分かっていませんでした。
研究手法と成果
脳内のAβは、生理的に産生と分解を繰り返すため、脳内には一定量のAβが存在しますが、ADの発症までの20年ともいわれる長い期間を経て、加齢などによって脳内にたまるようになります。その間にアミノ末端構造がさまざまな修飾を受けることが分かってきました。
そこで、国際共同研究グループはまず、脳内に一定量存在するAβと見分けるためにラジオアイソトープで標識した多様なアミノ末端構造を持つAβを化学合成し、ラットの海馬(大脳の一部)に注入して分解されやすさを解析しました。その結果、生理的Aβやアミノ末端のアミノ酸が削られただけのAβは速やかに分解される一方で、アミノ末端が削られて環状構造を持つピログルAβの分解は極端に遅くなり、注入後1時間たっても大部分が分解されずに残っていることが明らかになりました(生物学的半減期は、生理的Aβの5倍延長)(図1左)。
また、ADの患者の剖検(解剖で調べた)脳でこれらの多様なAβの存在量を定量的に解析しました。脳内のAβは塊となってアミロイド斑を作っているため、この塊をほぐす特殊な処理を行い、それぞれのAβの特殊な修飾を認識する特異抗体を用いた免疫化学的検出法により、検出の特異性と感度を向上させて定量すると、ピログルAβの総量は全体の40%以上であることが分かりました(図1右)。生理的Aβの量は5%以下でした。
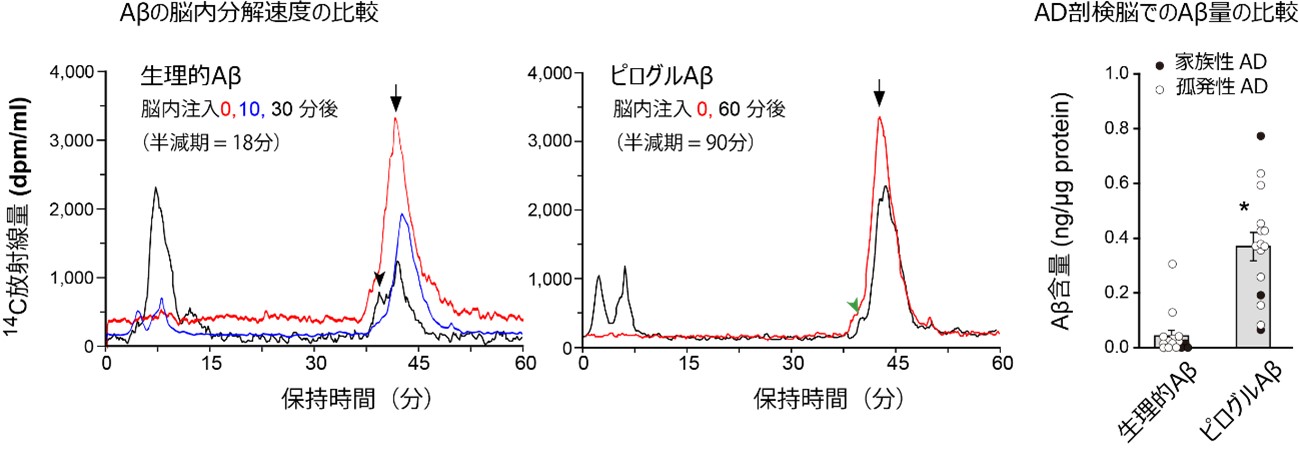 図1 生理的AβとピログルAβの脳内分解速度の比較(ラット)とAD脳内含量の比較 |
(左)ラットの海馬における生理的Aβと「悪玉Aβ」であるピログルAβの分解速度の比較。生理的Aβと比べピログルAβは分解速度がかなり遅いことが分かった。
(右)AD患者の脳内からAβを免疫化学的検出法で定量した。総量で見ると、生理的Aβは5%以下であるが、ピログルAβは40%以上あった。
従来のアルツハイマー病モデルマウス(APPトランスジェニックマウス)や次世代型アルツハイマー病モデルマウス(Appノックインマウス)に対して、遺伝子操作によりAβの生理的分解を行うネプリライシンが働かないようにしたマウスを作製し、12カ月齢、18カ月齢、24カ月齢まで飼育して、脳内にたまったAβの種類や量を、免疫組織化学、生化学的手法、質量分析法を用いて詳細に調べました。
ネプリライシンが働かないADモデルマウス脳では、ネプリライシンがよく働くADモデルマウス脳と比較して、生理的Aβと同じアミノ末端構造を持つAβの量が12カ月齢まで高値を示しましたが、意外にもその後、差が縮まりました。その一方、興味深いことにピログルAβの量は、ネプリライシンが働かないモデルマウス脳では月齢依存的に脳内にどんどんたまり、24カ月齢で2.5倍に上昇しました(図2)。
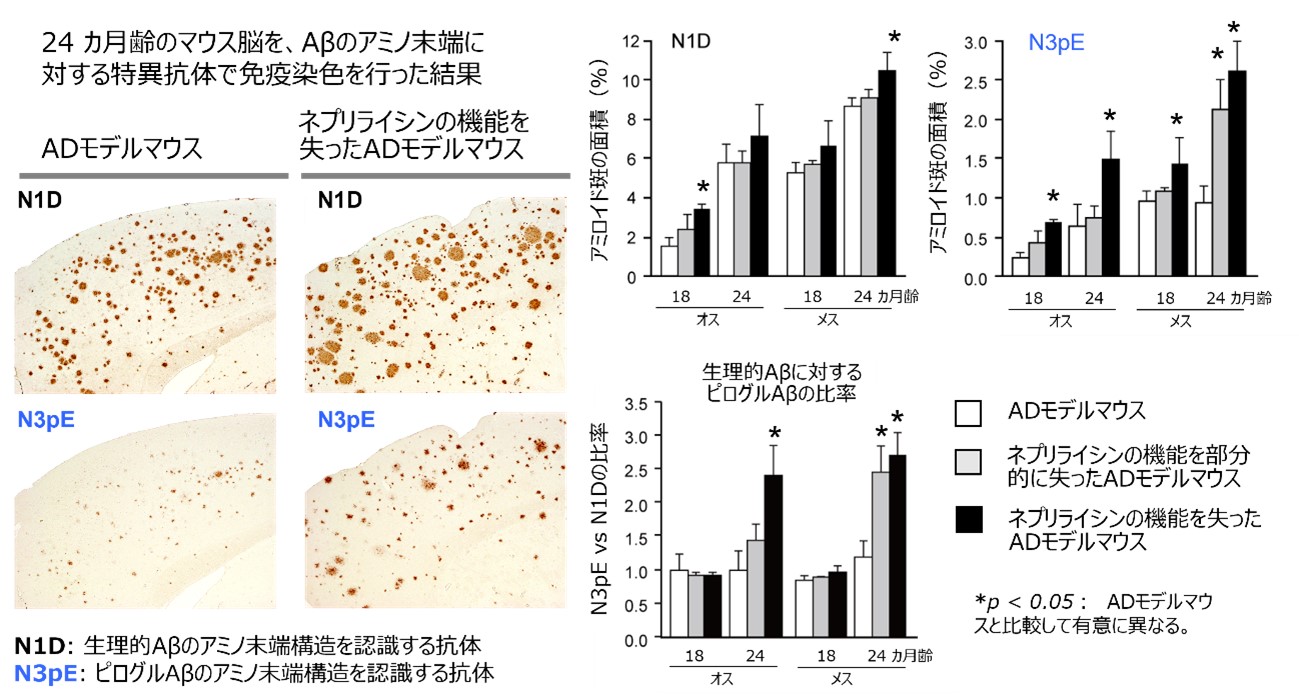 図2 ネプリライシン活性低下によるピログルAβ蓄積の促進 |
(左)24カ月のマウスの脳をAβのアミノ末端に対する特異抗体を使って免疫染色を行った。ネプリライシンが働かないADモデルマウスの脳は、ネプラリライシンがよく働くADモデルマウスと比較して、生理的Aβも多いが、ピログルAβはさらに多いことが分かった。
(右)ネプリライシンがよく働くADモデルマウスと部分的に働かないADモデルマウス、全く働かないADモデルマウスのアミロイド斑(生理的AβとピログルAβ)の面積と、生理的Aβに対するピログルAβの比率を比較した。生理的Aβのたまり方は各モデルマウスでその差が縮まっている。一方、ピログルAβはネプリライシンが全く働かないADモデルマウスでは非常に増えていた。
この結果を確実にするためには原理が異なる別手法で同様の結果を導く必要があります。他の研究者らは質量分析法を用いて、これまでAD脳やモデルマウス脳からピログルAβの検出を試みましたが、ほとんどの場合、検出に失敗してきました。その理由は、解析する組織の前処理方法に問題がありました。国際共同研究グループでは、脳組織で固まっているAβを強酸処理によりほどき、さらにペプチダーゼ処理を行い、Aβ1-16またはAβ3pE-16(ピログルAβの断片)にフラグメント化して、質量分析を行ったところ、ネプリライシンが働かないADモデルマウス脳でAβ3pE-16のシグナルを検出しました(図3)。
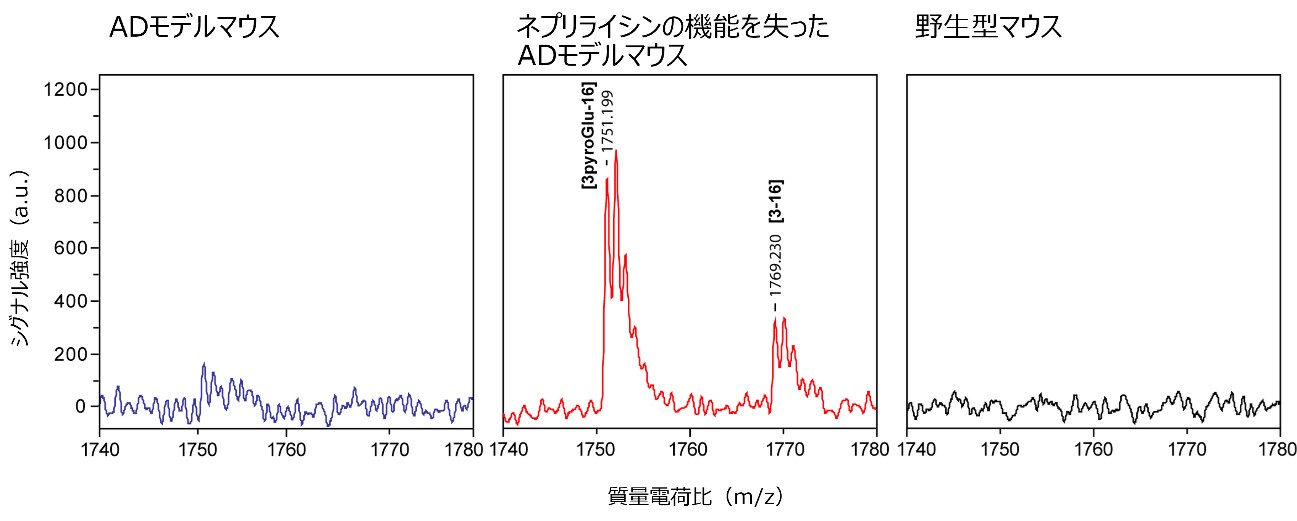 図3 質量分析法を用いたピログルAβの検出 |
ネプリライシンが働くADモデルマウスと働かないADモデルマウス、野生型マウスについて、脳内に固着したAβを強酸処理などによってほどき、Aβ1-16またはAβ3pE-16(ピログルAβの断片)にフラグメント化して質量分析した。その結果、ネプリライシンが働かないADモデルマウスの脳からはAβ3pE-16(図の表記は「3pyroGlu-16」)のシグナルが検出された。[3-16]はAβ3E-16であり、生理的Aβのアミノ末端のアミノ酸が2個削られた後にピログルタミル化を受けていないAβ。
ADの画像診断には、PET[9]を用いて脳内アミロイド量を評価するアミロイドイメージングプローブとしてピッツバーグ化合物B(PiB)[9]が広く使用されています。国際共同研究グループの樋口部長らは以前PiBが生理的AβよりもピログルAβにより高い親和性と結合能力を示すことを報告しました注1)。そこで、PiBプローブを用いて、ネプリライシンを働かないようにしたADモデルマウスでアミロイドイメージングを行ったところ、PiBシグナルは、ピログルAβ量の増加(図2右)と一致して、マウスの月齢依存的に増加しました(図4)。このように、PiBプローブを用いることで、ピログルAβの増加を捉え、結果的に脳内ネプリライシン量の変化を監視できることが分かりました。
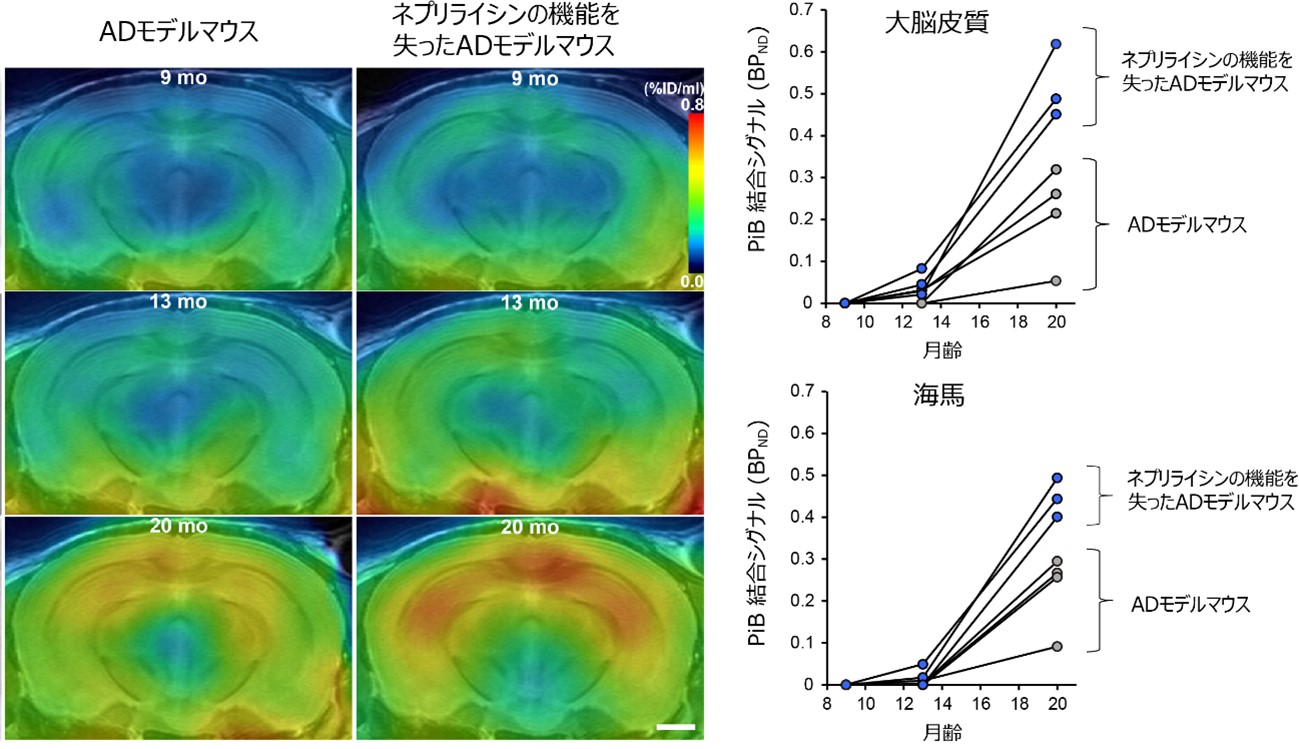 図4 ネプリライシン活性低下によるPiBシグナルの増強 |
(左)ネプリライシンが働くADモデルマウスと働かないADモデルマウスの脳内のPiBシグナルの強弱を示した。青から緑、黄、赤に従ってシグナルが強くなる。moはmonth(月)のこと。
(右)PiBシグナルは、大脳皮質でも海馬でも、ネプリライシンが働かないADモデルマウスの方が強かった。いずれのモデルマウスでも月齢12カ月を超えてから急激に強まった。
ピログルAβは、生理的Aβのアミノ末端の二つのアミノ酸が切断を受け、三つ目のグルタミン酸が環状構造を獲得しています。西道チームリーダーはピログルAβの産生にはエキソペプチダーゼが関わることを以前より指摘していました注2)。ネプリライシンは別名中性エンドペプチダーゼとも呼ばれ、ペプチド内部で切断を行うため、ネプリライシンが働かない状況下では、エキソペプチダーゼがAβの分解を補償する経路になると考えました。
そこで、アミノペプチダーゼやジペプチジルペプチダーゼ、グルタミン酸の環化酵素がAβ分解に関わる可能性に注目し、モデルマウス脳からこれらの酵素を精製し、Aβと反応させると、いずれも十分な切断活性を有することが分かりました(図5左)。重要な発見として、アミノペプチダーゼやジペプチジルペプチダーゼの脳内発現量が、ネプリライシンを働かないようにしたADモデルマウスでは月齢依存的に増加することが示されました(図5中)。さらに興味深いことに、グルタミン酸環化酵素の一つのアイソフォーム(類似タンパク質)の発現量が同様に増加し、さらにピログルタミル化したグルタミン酸残基をペプチドから外すアミノペプチダーゼの発現量が逆に低下することも明らかになりました(図5右)。
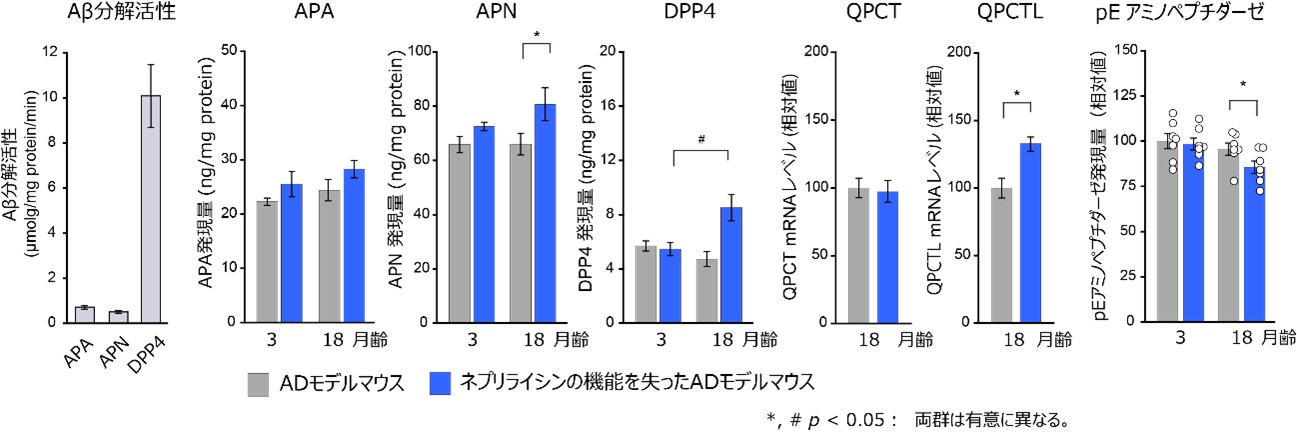 図5 ネプリライシンの機能低下による二次的なAβ分解経路構成酵素群の誘導 |
二次的なAβ分解経路構成酵素群。APA:アミノペプチダーゼA、APN:アミノペプチダーゼN、DPP4:ジペプチジルペプチダーゼ4、QPCT:グルタミン酸環化酵素、QPCTL:グルタミン酸環化酵素様タンパク質。
(左)APA、APN、DPP4はAβ分解活性を持つことが示された。
(中)APN、DPP4の脳内発現量は、ネプリライシンが働かないADモデルマウスでは月齢が長くなるほど増加した。
(右)ネプリライシンが働かないADモデルマウスでは、グルタミン酸環化酵素アイソフォームであるQPCTLの脳内発現量は月齢が長くなると増加したが、ピログルタミル化したグルタミン酸残基をペプチドから外すアミノペプチダーゼの発現量が逆に低下した。
注1)Maeda J, Ji B, Irie T, Tomiyama T, Maruyama M, Okauchi T, Staufenbiel M, Iwata N, Ono M, Saido TC, Suzuki K, Mori H, Higuchi M, Suhara T. Longitudinal, quantitative assessment of amyloid, neuroinflammation, and anti-amyloid treatment in a living mouse model of Alzheimer's disease enabled by positron emission tomography. J Neurosci. 2007 Oct 10;27(41):10957-68. doi: 10.1523/JNEUROSCI.0673-07.2007. PMID: 17928437; PMCID: PMC6672864.
注2)Saido TC, Iwatsubo T, Mann DM, Shimada H, Ihara Y, Kawashima S. Dominant and differential deposition of distinct beta-amyloid peptide species, A beta N3(pE), in senile plaques. Neuron. 1995 Feb;14(2):457-66. doi: 10.1016/0896-6273(95)90301-1. PMID: 7857653.
今後の期待
本研究で、生理的に産生するAβがアルツハイマー病の脳でピログルAβに変化し悪玉化する仕組みが明らかになりました。これにより、既に脳にたまっているピログルAβを標的として取り除くドナネマブとは異なり、ピログルAβが出来上がる前に悪玉化に関わるアミノペプチダーゼやジペプチジルペプチダーゼ、さらにピログルタミル環化酵素の働きを抑える薬の開発が、新しいアルツハイマー病の予防・治療につながると期待されます。これらの酵素に対する低分子阻害剤は、研究用試薬または既存薬として存在するため、臨床応用に向けた開発やドラッグリポジショニング[10]ができる可能性があり、予防や治療の選択肢が広がります。また、ネプリライシンの活性が十分に高いときはこの悪玉化経路は働かないため、ネプリライシンの発現を健常者レベルに維持するための創薬も効果的です。そこで、ネプリライシンを基軸とした予防・治療法の開発にも注力し、研究を続けていきます。
このようにアルツハイマー病の脳にたまるAβの大半はピログルAβですが、この悪玉を優先的に脳内にためるアルツハイマー病モデル動物は開発されていません。今後は開発されない理由を突き止め、これを解決したモデルマウスを開発する必要があります。これによりアルツハイマー病の神経病理を深く理解し創薬研究に資することができます。また、ドナネマブなど、アルツハイマー病の抗体医薬が抱える脳内浮腫や脳出血などの副反応の仕組みを明らかにすることで、より安全に臨床で使用できるようになると期待できます。
論文情報
<タイトル>
Metabolic resistance of Aβ3pE-42, a target epitope of the anti-Alzheimer therapeutic antibody, donanemab.
<著者名>
Nobuhisa Iwata, Satoshi Tsubuki, Misaki Sekiguchi, Kaori Watanabe-Iwata, Yukio Matsuba, Naoko Kamano, Ryo Fujioka, Risa Takamura, Naoto Watamura, Naomasa Kakiya, Naomi Mihira, Takahiro Morito, Keiro Shirotani, David M.A. Mann, Andrew C. Robinson, Shoko Hashimoto, Hiroki Sasagur2, Takashi Saito, Makoto Higuchi, Takaomi C. Saido.
<雑誌>
Life Science Alliance
<DOI>
10.26508/lsa.202402650
補足説明
[1] アルツハイマー病(AD)
アルツハイマー病はドイツの精神科医、アルツハイマー博士により1905年に報告された進行性の記憶障害を伴う認知症。主に高齢で発症し、徐々に進行して日常生活に支障を来すようになり、最終的には意思疎通ができなくなる。日本を含む先進国では、高齢期発症の認知症のうちで最も多いタイプの疾患となっている。
[2] アミロイドベータ(Aβ)
アミロイド前駆体タンパク質(APP)から、2種類のタンパク質分解酵素によって切断されて産生する40~42個程度のアミノ酸が連なったペプチド。アルツハイマー病患者の脳に出現する老人斑の主要な構成成分であり、アルツハイマー病発症の原因になる重要な分子である。産生直後のAβのアミノ酸配列は端からアスパラギン酸―アラニンーグルタミン酸で始まる。ピログルAβ([3]参照)と区別するため、ここでは生理的Aβと称している。
[3] ピログルAβ
生理的Aβのアミノ末端の二つのアミノ酸が切断され、三つ目のグルタミン酸が脱水縮合し環化を受けたAβ。生理的Aβよりも自己凝集能力が250倍ほど高いため、老人斑形成時の核となることが示唆されている。最近、米国や日本で市販された早期アルツハイマー病治療薬である抗体医薬ドナネマブの標的Aβである。
[4] ネプリライシン
疎水性アミノ酸残基のアミノ末端側でタンパク質のペプチド結合を切断する細胞膜結合型のタンパク質分解酵素であり、Aβをペプチド内部で2カ所切断する。エンケファリナーゼ、中性エンドペプチダーゼ24.11とも呼ばれる。理研では、ネプリライシンが脳内で主要なAβを分解する酵素であることやネプリライシンの発現制御因子を発見し、公表している注3~7)。
注3)2000年2月1日プレスリリース「脳内のβアミロイド分解系路を解明」
https://www.riken.jp/medialibrary/riken/pr/press/2000/20000201_1/20000201_1.pdf
注4)2001年5月21日プレスリリース「孤発性アルツハイマー病の原因解明に大きく前進」
https://www.riken.jp/medialibrary/riken/pr/press/2001/20010521_1/20010521_1.pdf
注5)2014年4月14日プレスリリース「次世代型アルツハイマー病モデルマウスの開発に成功」
https://www.riken.jp/press/2014/20140414_1/
注6)2021年11月9日プレスリリース「アルツハイマー病の新しい治療標的を発見」
https://www.riken.jp/press/2021/20211109_1/
注7)2024年8月7日プレスリリース「ドーパミンによるアミロイドβ分解機構の発見」
https://www.riken.jp/press/2024/20240807_1/
[5] アルツハイマー病のモデルマウス
AD病態を示す遺伝子改変マウスで、従来型のモデルは家族性ADの遺伝子変異を導入したAPPを過剰発現するトランスジェニックマウスがある。これらのモデルの弱点を克服した次世代型モデルマウス(Saito et al., 2014 Nat Neurosci; Sato et al., 2021 J Biol Chem)は西道チームリーダーらが開発に成功している。
[6] エキソペプチダーゼ
アミノペプチダーゼやジペプチジルペプチダーゼなど、ペプチドのアミノ末端側からアミノ酸を切断する酵素の総称であり、Asp(酸性アミノ酸)を切断にするアミノペプチダーゼA(APA)、Ala(中性アミノ酸)を切断するAPN、さらにジペプチド(2個のアミノ酸)単位で切断するジぺプチジルアミノペプチダーゼ(DPP)などがある。
[7] グルタミン酸環化酵素
ペプチドのアミノ末端のグルタミン酸を脱水縮合、またはグルタミンを脱アミノ化反応により、環状構造を持つピログルタミン酸に変換する酵素であり、グルタミルシクラーゼ(QPCT)やそのアイソフォームであるグルタミルシクラーゼ様タンパク(QPCTL)がある。ピログルタミル化されたアミノ酸をアミノ末端に持つペプチドは、一般にアミノペプチダーゼによる切断に抵抗性を示す。
[8]ドナネマブ
イーライ・リリー社が開発した早期アルツハイマー病治療薬である抗体医薬。米国に次いで日本でも厚生労働省により認可された。上述のように、ドナネマブはピログルAβ(3-pyroglutamyl Aβ、Aβ3pE;Eはグルタミン酸の一文字表記)を認識するモノクローナル抗体である。
[9] PET、ピッツバーグ化合物B(PiB)
PETはポジトロン断層撮影(positron emission tomography)の略称で、生体の生理機能や病的変化を画像化する方法として、臨床診断にも応用されている。本研究では、マウスなどの小動物用の高分解能microPETを使用している。ピッツバーグ化合物Bは放射性アイソトープで標識するアミロイドイメージングプローブで、ピッツバーグ大学で開発された。AD脳に沈着する老人斑を構成するAβに特異的に結合する能力を持つため、患者に投与して、PET装置により老人斑の分布を画像化し、蓄積量を定量することができる。
[10] ドラッグリポジショニング
別の疾患の既存薬や開発中または開発中止となった医薬品化合物を新たな疾患の治療薬として転用する方法。ヒトでの安全性や体内動態が確認されており、既存の臨床データを利用できるため、新たな安全性試験などを行う必要がなく、新薬開発に要する期間・コストを縮小できる。






 受験生
受験生 在学生
在学生 卒業生
卒業生 保護者等
保護者等 地域・一般
地域・一般 企業・研究者
企業・研究者 教職員
教職員