2022年10月14日
エボラウイルススパイクタンパク質の挙動を追跡できるシステムの開発に成功
長崎大学高度感染症研究センターウイルス感染動態研究分野の南保明日香教授の研究グループはバイオセーフティレベル(BSL)-2 でエボラウイルス感染を再現できるシステムを応用して、エボラウイルスタンパク質の挙動をリアルタイムに可視化できる新たなシステムを開発しました。
本研究成果は、微生物学の国際的な専門誌であるFrontiers in Microbiology に掲載されました。エボラウイルスは高い致死率を伴う重篤なエボラ出血熱(エボラウイルス病)を引き起こす病原体です。エボラウイルスは高度安全実験施設(BSL-4 施設)でしか取り扱うことができないため、感染機構には不明な点が多く残されています。今回の研究で、当研究室の古山若呼助教らは、エボラウイルスの感染に重要なスパイクタンパク質の感染細胞での挙動をリアルタイムに追跡できるシステムを開発しました。今後、このシステムを活用することで、ウイルスの増殖メカニズムの解明や新規治療薬の開発に繋がることが期待されます。
■発表のポイント
• エボラウイルス感染に重要なスパイクタンパク質の感染細胞での挙動をリアルタイムに追跡できるシステムを開発しました。
• このシステムを活用することで、まだ解析が進んでいないウイルス増殖メカニズムが明らかになることが期待されます。
• さらに、このプロセスを標的とした新規治療薬の開発へと展開することが期待されます。
■発表内容
<研究の背景>
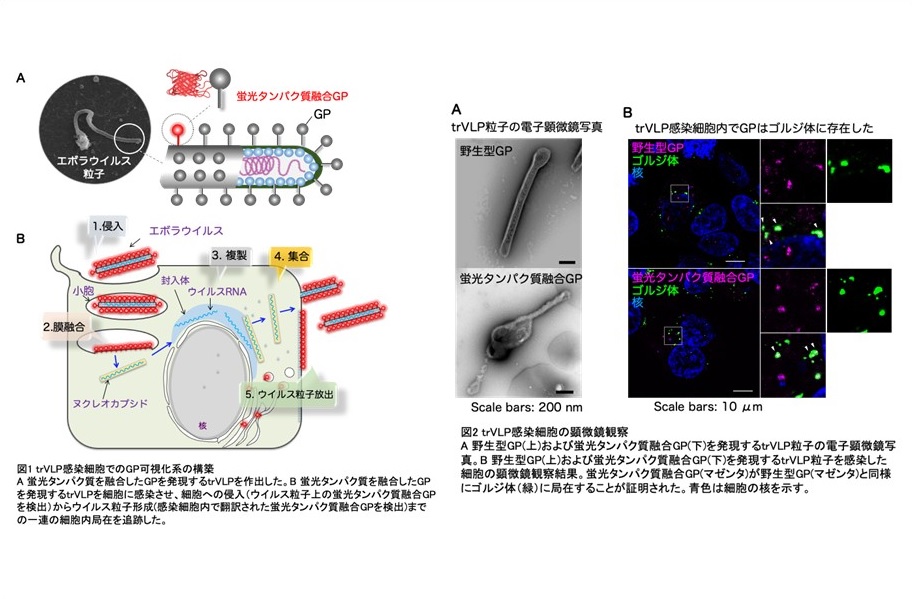
エボラウイルスは高い致死率を伴う重篤なエボラ出血熱(エボラウイルス病)を引き起こす病原体であり、世界規模での公衆衛生において最も懸念すべき新興感染症の1つとして認識されています。特にこの10 年の間に2度の大規模なアウトブレイクを引き起こしたことから、早急な対策が望まれていますが、現時点では有効な予防•治療法は限定されています。エボラウイルスは粒子上に唯一glycoprotein (GP)と呼ばれるスパイクタンパク質を発現します(図1A)。GP はエボラウイルスが標的細胞に感染する際に重要な役割を担うため、治療薬を開発する上で重要な標的の1つとして認識されています。その一方で、感染細胞で新たに産生されるGP がどのようにウイルス粒子に取り込まれるのか詳細なメカニズムについては解明されていませんでした。
<研究成果の内容>
エボラウイルスの取り扱いは通常BSL-4 施設に限定されています。これに対して、近年、エボラウイルスの増殖に必要最低限の遺伝子のみを内包し、BSL-2 で感染サイクルを再現できるエボラウイルス様粒子tetracistronic transcription- and replication-competent virus-like particles(trVLP)が開発されました。このシステムを応用し、GP に蛍光タンパク質を融合させることにより、trVLP 感染細胞でのGP の細胞内局在について観察を試みました。第一に、蛍光タンパク質を融合させたGP(図1)は、通常のGP と同様にひも状の形態を有するウイルス粒子表面に発現し (図2A)、且つ正常に細胞に取り込まれることが証明されました。従来、感染細胞で発現したGP は小胞体-ゴルジ体で糖鎖修飾された後に、小胞輸送により細胞表面に輸送されることが報告されています(図1B)。trVLP 感染細胞の顕微鏡観察により、蛍光タンパク質融合GP が野生型GP と同様にゴルジ体に局在することが明らかになりました(図2B)。以上、BSL-2 環境下においてウイルス粒子の取り込みから新たなウイルス粒子が形成されるまで、一連のウイルス生活環でのGP の局在を追跡可能とする新規システムの開発に成功しました。
 |
<社会的意義>
これまで開発されたエボラウイルス感染阻害薬の多くは、最も高い病原性を持つウイルス株を標的としたものです。従って、今後、他種ウイルス株や変異ウイルスによるアウトブレイクが発生した場合、現存の治療薬では対応できない可能性があるため、多様な作用機序を持つ新規薬剤の開発が喫緊の課題となっています。今回開発したシステムを用いることで、特に、まだ詳細が明らかにされていない、ウイルス粒子にGP が取り込まれるメカニズムが解明されることが期待されます。さらにこのプロセスを標的とした治療薬の開発へと展開することで、新規治療薬の創出に繋がることが期待されます。
■論文情報
論 文 名 :Development of an imaging system for visualization of Ebola virus glycoprotein throughout the viral lifecycle
掲 載 誌:Frontiers in Microbiology
D O I:10.3389/fmicb.2022.1026644
U R L: https://www.frontiersin.org/articles/10.3389/fmicb.2022.1026644/abstract
■研究資金
本研究は、「科学研究費助成事業」(研究活動スタート支援:21K20762)、「国立研究開発法人日本医療研究開発機構(AMED)」[新興・再興感染症研究基盤創生事業(BSL4 拠点形成研究:JP22fm0208101] [新興・再興感染症研究基盤創生事業(多分野融合研究領域:21461223)]、共同利用・共同研究拠点事業共同研究(長崎大学熱帯医学研究)、武田科学振興財団ハイリスク新興感染症研究助成、公益財団東京生化学研究会研究助成の支援を受けて実施しました。
*補足・用語説明
エボラウイルス感染機構:エボラウイルスはGP を介して標的細胞表面の受容体に結合後、エンドサイトーシスの1つであるマクロピノサイトーシスにより標的細胞に取り込まれる。小胞内の成熟に伴い、GP の立体構造が変化することでウイルス粒子エンベロープと小胞膜との融合が誘導され、ウイルスゲノムを含むヌクレオカプシドが細胞質へと放出される。これに引き続いてウイルスゲノムが複製・転写され、翻訳されたウイルスタンパク質はウイルスゲノムとともに集合し、細胞表面から子孫ウイルス粒子を形成し、細胞外へと放出される(図1)。
GP:エボラウイルスがウイルス粒子に発現する唯一の糖タンパク質(スパイクタンパク質)であり、標的細胞表面の受容体への結合と膜融合に関与するため、中和抗体の唯一の標的となる。感染後、発現したGP は小胞体、ゴルジ体で糖鎖が付加された後に小胞輸送により細胞表面へ輸送され、ウイルス粒子に取り込まれると考えられている。
tetracistronic transcription- and replication-competent virus-like particles(trVLP):
エボラウイルスの増殖に必要最低限の遺伝子のみを有するミニゲノムと、エボラウイルス増殖に必須なタンパク質を外来遺伝子から発現することで、複数感染サイクルを模倣することができるエボラウイルス様粒子。BSL-2 レベルで取り扱うことができる(Watt A. et al. J Virol. 2014;88
(18):10511-24)。






 受験生
受験生 在学生
在学生 卒業生
卒業生 保護者等
保護者等 地域・一般
地域・一般 企業・研究者
企業・研究者 教職員
教職員