2022年01月21日
歯周病菌ジペプチジルペプチダーゼ7は広範な基質特性を有し,この活性により血糖調節に関与する
長崎大学歯学部の根本孝幸名誉教授,根本優子客員研究員らと岩手医科大学の佐々木実教授,下山佑講師らのグループは,歯周病菌のペプチダーゼDPP7が広範な基質特異性を有し,血糖調節に関与するインクレチンなどの生理活性ペプチド分解能を有することを初めて示しました(1)。
本研究成果は,糖尿病を含め,歯周病と全身疾患の関連性についての分子機構を解明する重要な手がかりとなると期待されます。
歯周病は糖尿病をはじめとして,認知症,腎臓疾患などのさまざまな全身疾患と関連することが報告されていますが,その分子機構はいまだに明らかになっていません。これまで根本グループは歯周病菌が発現するペプチダーゼが歯周病-糖尿病連関に関わるという仮説に基づいて,歯周病菌ペプチダーゼの研究を行ってきました(2)。本研究では4種類のペプチダーゼDPP4, DPP5, DPP7, DPP11によるインクレチン(GLP-1およびGIP)分解の詳細な検討を行い,DPP4に加えて,DPP7がより強力にインクレチンを分解することを見出し,さらにその広範な基質特異性を示す分子機構を明らかにしました。
本研究は,アメリカ生化学分子生物学会誌「Journal of Biological Chemistry」(2022年1月12日付)に掲載されました。
|
|
主たる歯周病菌であるP. gingivalisはアミノ酸を代謝して細菌増殖に必要なエネルギーを産生し,全ての細菌細胞構成要素の合成を行い増殖します。従って,P. gingivalisのアミノ酸代謝の全容を明らかにすることは,歯周病予防にとって重要です。
細菌にとっての栄養タンパク質はペプチドに分解された後,細胞壁を通過し,細胞壁と細胞膜に挟まれたペリプラズム層に移行します。そこでは4種類のジペプチジルペプチダーゼ(DPP4,DPP5,DPP7,DPP11)とDPPによるペプチド分解を補助する2種類のエキソペプチダーゼ(PTP-AとAOP)により2アミノ酸がつながるジペプチドに分解され,その後,ジペプチドトランスポーターであるPotにより細胞内に取り込まれます(3)。認識するP1位置(ペプチドのアミノ末端から2番目)のアミノ酸の違いによりDPPは多くの組み合わせのジペプチドを産生するものの,親水性アミノ酸であるトレオニン,セリン,グルタミン,アスパラギン,およびヒスチジンを認識するDPPはこれまで見いだされていませんでした。根本グループは本研究において,疎水性アミノ酸特異的とされてきたDPP7がこれらの5種類のアミノ酸を含めたより広い基質特異性を持つことを明らかにしました。
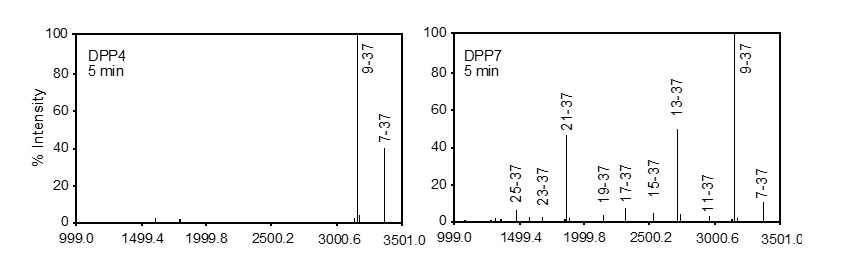
一方,小腸から分泌される生理活性ペプチドであるインクレチン(GLP-1とGIP)は膵臓からのインスリンの分泌を促して血糖調節を行いますが,ヒトの体内ではDPP4によって速やかに分解され,数分で活性を失います。本研究ではMALDI-TOF MS解析により歯周病菌由来DPP7はDPP4より速い速度でインクレチンを分解することを明らかにしました(図1)。さらにインスリンを含む種々の生理活性ペプチドがDPP7により分解されることも見いだしました。DPP7の血糖調節システムへの関与はマウス耐糖試験でも示され,DPP7の静注により血漿GLP-1とインスリン濃度は低下し,それに伴って最高血糖値の上昇と高血糖時間延長が起こることを示しました。
この従来見逃されていたDPP7の広範な基質特異性の機構を明らかにするために,DPP7認識部位のカルボキシル基(C)末側にアミノ酸を付加した蛍光ペプチド基質と,追加部分を分解するエキソペプチダーゼを組み合わせた新規解析法を確立し酵素学的解析を行いました。その結果,DPP7は切断部位のC末側にアミノ酸残基がある場合は,酵素活性のパラメーターであるkcatが大きく上昇し,従来切断できないとされていた親水性アミノ酸も切断できることが明らかになりました。今回の詳細な基質特異性の再検討により,広範な基質特異性を有するDPP7を中心として,P. gingivalisは4種類のDPP群により全てのポリペプチドをジペプチドに代謝できることが明らかになり,菌の増殖と病原性を担保することがわかりました。
歯周ポケットに生息する嫌気性の口腔細菌はDPP7とDPP4遺伝子を有し,これらペプチダーゼ活性を発現することから(4),歯周病の程度と血中細菌量,インクレチン-インスリン濃度低下との関連についての検討が重要です。さらに,多機能生理活性ペプチドであるインクレチンの分解を通して,歯周病が全身の健康状態に関わる可能性も考えられ,今後の展開が注目されます。
本研究は従来不可能だったプロテアーゼによる基質ペプチドの切断位置のC末側アミノ酸の影響を定量的に解析することを可能にした点でも注目されます。
参考文献
(1) Ohara Nemoto, Y., Shimoyama, Y., Ono, T., Sarwar, M.T., Nakasato, M., Sasaki, M., Nemoto, T.K.: Expanded substrate specificity supported by P1’ and P2’ residues enables bacterial dipeptidyl-peptidase 7 to degrade bioactive peptides. J Biol Chem (https://www.jbc.org/article/S0021-9258(22)00025-4/fulltext)
根本優子,根本孝幸,小野俊夫,Sarwar, M.T.
長崎大学歯学部 客員研究員(旧 口腔分子生化学分野,SMT 現 イスラム大学 生物学部 栄養・食品応用工学講座)
下山佑,佐々木実 岩手医科大学歯学部 分子微生物学分野
中里茉那美 岩手医科大学歯学部 歯周治療学分野
(2) Nemoto, T.K., Ohara-Nemoto, Y.: Dipeptidyl-peptidases: Key enzymes producing entry forms of extracellular proteins in asaccharolytic periodontopathic bacterium Porphyromonas gingivalis. Mol Oral Microbiol (2020) 36(2): 145-145. doi.org/10.1111/omi.12317
(3) Ohara-Nemoto, Y., Sarwar, M.T., Shimoyama Y., Kobayakawa T., Nemoto, T.K.: Preferential dipeptide incorporation of Porphyromonas gingivalis mediated by proton-dependent oligopeptide transporter (Pot). FEMS Microbiol Lett (2020) 367, 1-8. doi: 10.1093/femsle/fnaa204
(4) Ohara-Nemoto, Y., Shimoyma, Y., Nakasato, M., Nishimata, H., Ishikawa, T., Sasaki, M., Kimura, S., Nemoto, T.K.: Distribution of dipeptidyl peptidase (DPP) 4, DPP5, DPP7, and DPP11 in human oral microbiota – potent biomarkers indicating presence of periodontopathic bacteria. FEMS Microbiol Lett (2018) 365(22) doi: 10.1093/femsle/fny221






 受験生
受験生 在学生
在学生 卒業生
卒業生 保護者等
保護者等 地域・一般
地域・一般 企業・研究者
企業・研究者 教職員
教職員