2016年08月18日
「細胞はどのようにして動くのか?」 その分子メカニズムの一端が明らかに
|
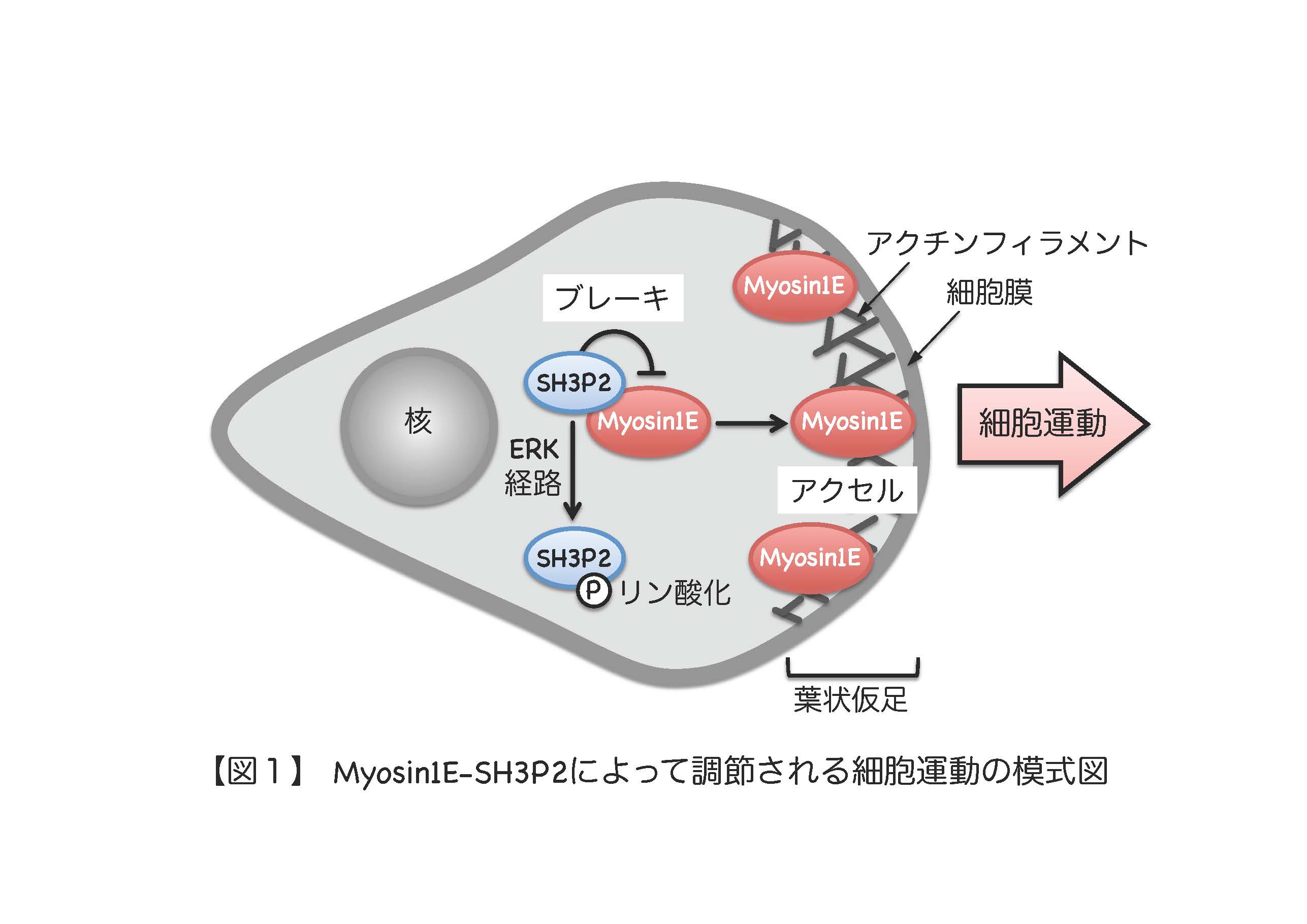
長崎大学大学院医歯薬学総合研究科の谷村進助教(分子創薬科学講座細胞制御学分野)らの研究グループは、細胞運動の新たな分子メカニズムを明らかにし、米国生命科学分野の学術誌 『The Journal of Cell Biology』 (2016年8月8日)に発表しました。なお、本研究成果は同誌の 『In Focus』 でも紹介されました。 細胞の運動は、胚の発生や、免疫監視システム、損傷の治癒過程など、生体が恒常性を維持するためには欠かせない細胞応答となっています。そのため、細胞運動は厳密に調節されていることが知られていますが、その分子メカニズムの全容解明には至っていません。これまでに研究グループは、細胞の運動にブレーキをかける因子としてSH3P2とよばれる分子を見いだしていましたが、それがどのようにして細胞運動を阻止しているのかは分かっていませんでした。そこで今回、研究グループはSH3P2に結合する因子を探索しました。その結果、Myosin1Eとよばれるアクチンフィラメント上を移動するモータータンパク質を見いだしました。また、分子生物学的手法を用いてSH3P2とMyosin1Eの結合様式やそれぞれの分子の役割について解析した結果、運動する細胞の先端に集まったMyosin1Eが葉状仮足(※1)形成を促進することで細胞運動のアクセルとして働くこと、一方Myosin1E と結合したSH3P2はMyosin1Eが先端に集まるのを阻害することで細胞運動のブレーキとして働くことが分かりました。さらに、SH3P2はERK経路(※2)によってリン酸化修飾を受けるとブレーキとしての役割を失う(Myosin1Eから離れる)ことも分かりました 【図1】。 がん細胞は悪性化して浸潤転移能を獲得しますが、それはがん細胞の運動能力が異常に高まってしまうことが一因として考えられます。ある種のがん細胞ではERK経路が恒常的に活性化されていることが知られており、そのような細胞ではSH3P2がリン酸化修飾を受けることで細胞運動のブレーキとしての役割が失われている可能性があります。本研究は、がん細胞がどのようにして浸潤転移するのか、その分子メカニズム解明の手がかりになるものと考えられます。
|
なお、本論文発表に関連して、第2回最先端創薬科学ワークショップで講演が行われます。
http://www.ph.nagasaki-u.ac.jp/center/WS2.html






 受験生
受験生 在学生
在学生 卒業生
卒業生 保護者等
保護者等 地域・一般
地域・一般 企業・研究者
企業・研究者 教職員
教職員