2024年07月03日
新型コロナウイルスの感染を抑制する天然物質を特定 ~多様な変異株に有効な革新的抗ウイルス薬の開発に期待~
■本研究のポイント
●糖の一種であるマンノース(Man)注1)に結合する天然物・プラディミシンAが新型コロナウイルス (SARS-CoV-2) の感染を抑制することを発見した。
●プラディミシンAがSARS-CoV-2表面に存在する糖鎖に結合できることを確認するとともに、プラディミシンAとウイルス糖鎖との結合メカニズムの概要を明らかにした。
●糖鎖構造はウイルスの変異によって変化しにくいことから、プラディミシンAを基にして様々な変異株に有効な革新的抗SARS-CoV-2薬を開発できる可能性がある。
■研究概要
名古屋大学糖鎖生命コア研究所※の中川 優 准教授、長崎大学高度感染症研究センターの安田 二朗 教授、木下 貴明 助教、櫻井 康晃 助教、広島大学の相田 美砂子 特命教授、赤瀬 大助教、富山県立大学の五十嵐 康弘 教授、大阪大学大学院理学研究科の伊藤 幸成 特任教授らの研究グループは、放線菌注2)が生産する天然物・プラディミシンAが新型コロナウイルスの表面に存在する糖鎖に結合してその感染を抑制することを新たに発見しました。
近年、新型コロナウイルス (SARS-CoV-2) の表面には多数の糖鎖が付加されていることが明らかにされています。本研究では、SARS-CoV-2が有する糖鎖にマンノースが多数含まれていることに着目し、マンノース結合活性を有するプラディミシンAがSARS-CoV-2の糖鎖に結合して細胞レベルでウイルス感染を抑制することを見出しました。さらに、プラディミシンAとウイルス糖鎖との結合メカニズムの概要も明らかにしました。糖鎖構造はウイルスの変異によって変化しにくいことから、これらの知見を基にして様々な変異株に有効な革新的抗SARS-CoV-2薬が開発されることが期待されます。
本研究成果は、2024年4月18日付化学誌「Bioorganic & Medicinal Chemistry」にオンラインで掲載されました。
 |
■研究背景と内容
ウイルスは増殖や感染をくり返すなかで変異しており、感染性や病原性を大きく変化させる場合があります。ウイルス感染症の最大の問題点は、ワクチンや抗ウイルス薬の有効性に影響を与える変異が起こり、新たなパンデミックが繰り返されることです。新型コロナウイルス (SARS-CoV-2) 感染症の蔓延にみられるように、現在の創薬技術ではウイルスの変異に迅速に対応することは容易ではなく、様々な変異株に有効なワクチンや抗ウイルス薬の開発が急務の課題となっています。
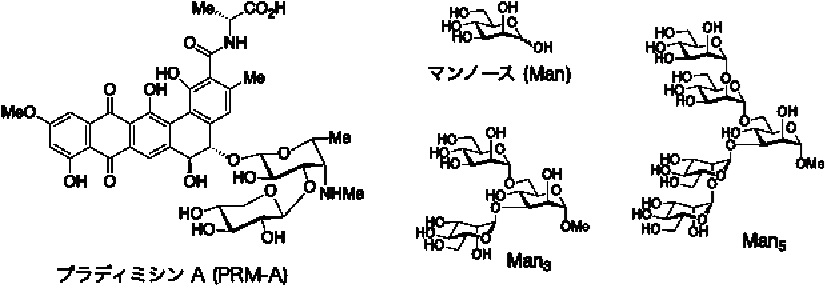
近年、SARS-CoV-2の表面には多数の糖鎖が付加されており、糖に結合するタンパク質・レクチンがこれらの糖鎖に結合してSARS-CoV-2の感染を抑制することが報告されています。糖鎖は遺伝子の直接の産物ではないためにウイルス変異の影響を受けにくいことから、レクチンは変異株に対応可能な抗ウイルス薬候補として注目されています。しかしながら、レクチンは赤血球を凝集させる、経口吸収性が低い、プロテアーゼによる分解を受ける、有害な抗原抗体反応を引き起こす危険性がある、など高分子のタンパク質であるがゆえに抗ウイルス薬として利用するには数多くの欠点があります。そこで本研究では、放線菌が生産する天然物・プラディミシンA (PRM-A, 図1) がマンノース (Man)に結合することに着目し、低分子である本天然物がレクチンと同様にSARS-CoV-2の糖鎖に結合してウイルス感染を抑制するかを検証しました。
|
|
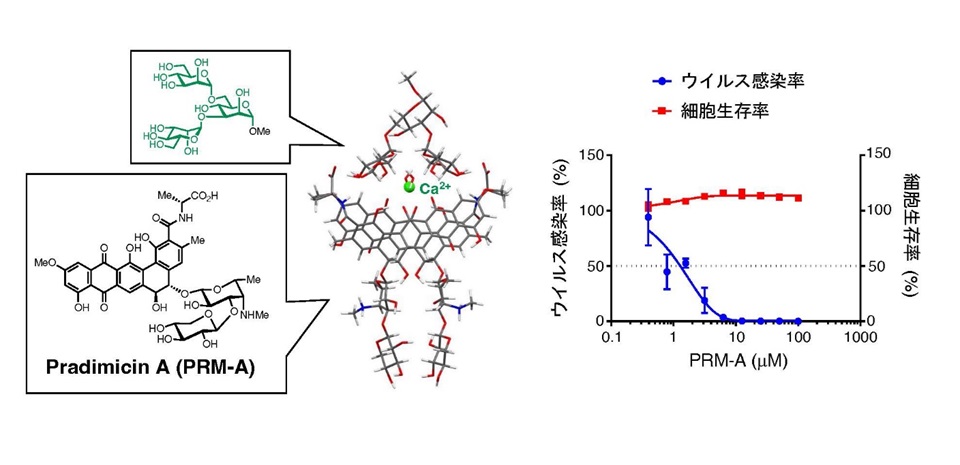
まず、PRM-AがSARS-CoV-2の糖鎖に結合することを確認するため、ウイルス糖鎖の部分構造に対応するオリゴ糖注3)を系統的に化学合成し、PRM-Aに対する結合活性を評価しました。その結果、PRM-AはManで構成される二分岐型オリゴ糖 (Man3, Man5; 図1) に極めて強く結合することが明らかとなり、ウイルス糖鎖に結合できることを確認しました。さらに、PRM-AとMan3が結合した複合体注4)を有機化学的手法と計算化学的手法を組み合わせて解析したところ、二分子のPRM-Aがカルシウムイオンを介して二量体注5)を形成してMan3の二つの分岐末端と相互作用することが示唆され、PRM-Aとウイルス糖鎖の結合メカニズムの概要も分子レベルで明らかにしました (図2)。これらの知見を基に、SARS-CoV-2(欧州株)のヒト気管支上皮由来Calu-3細胞に対する感染阻害試験を行なったところ、PRM-Aは細胞毒性を示すことなくSARS-CoV-2の感染を抑制すること (図3)、さらにこのPRM-Aによるウイルス感染抑制活性はMan3共存下で大幅に低下することが確認され、PRM-AがSARS-CoV-2の糖鎖に結合してウイルス感染を抑制することが明確となりました。
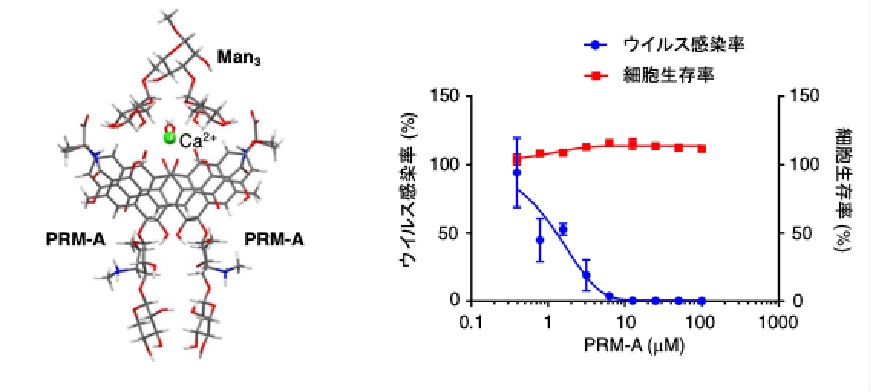 図2 PRM-AとMan3の複合体構造 図3 PRM-Aを用いたSARS-CoV-2感染阻害試験 図2 PRM-AとMan3の複合体構造 図3 PRM-Aを用いたSARS-CoV-2感染阻害試験 |
低分子化合物であるPRM-Aは、タンパク質のレクチンと比べて化学的に安定であり、細胞毒性などの欠点ももたず、かつ化学合成も可能であることから、抗ウイルス薬としての資質に優れています。今後は、本研究で得られた成果を基にウイルス糖鎖に結合する抗SARS-CoV-2薬の開発研究が大きく進展することが期待されます。
■成果の意義
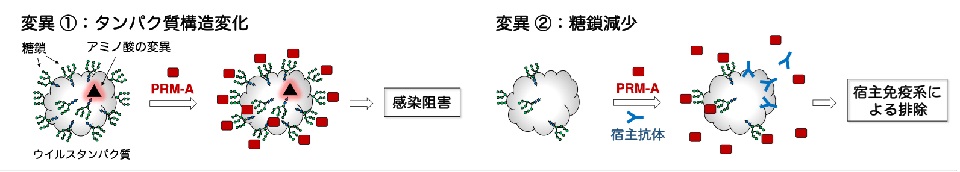
本研究では、PRM-Aが糖鎖を標的とした新しいタイプの抗SARS-CoV-2薬のリード化合物注6)として有望であることを示しました。SARS-CoV-2の表面に存在する糖鎖は、宿主細胞への感染段階に関与しているだけでなく、宿主免疫系からエピトープ注7)を保護する役割を果たしていることが知られています。糖鎖は遺伝子の直接の産物ではないためにウイルス変異の影響を受けにくいうえ、万が一SARS-CoV-2がPRM-Aから逃れるために糖鎖を消失させる変異を起こした場合はエピトープが露出して宿主免疫系が機能することを考慮すると、PRM-Aは様々なウイルス変異に対応できると考えられます (図4)。今後PRM-Aに基づく抗SARS-CoV-2薬が開発・実用化されれば、SARS-CoV-2によって繰り返されるパンデミックの完全抑制につながると期待されます。
 |
本研究は、公益社団法人日本農芸化学会 第50回研究奨励金および第21回農芸化学研究企画賞助成金、長崎大学高度感染症研究センター 新興感染症制御研究拠点共同研究助成金、および科研費の支援のもとで行われたものです。
【用語説明】
注1)マンノース(Man):
単糖の一種。タンパク質に結合している糖鎖の主要構成糖の一つ。
注2)放線菌:
土壌中に存在する微生物の一種。抗生物質を生産する能力に優れた微生物として注目されている。
注3)オリゴ糖:
単糖が2〜10個程度連結した物質の総称。代表例としてショ糖や乳糖がよく知られている。
注4)複合体:
二つ以上の分子や金属イオンが合わさって一体となっているものの総称。コンプレックスとも呼ばれる。
注5)二量体:
二つの同種の分子が物理的・化学的な力によってまとまった物質のこと。三つ、四つの分子がまとまった物質はそれぞれ三量体、四量体と呼ぶ。
注6)リード化合物:
医薬品の原石となる化合物のこと。リード化合物の薬効と安全性を高めていくことで医薬品が開発される。
注7)エピトープ:
免疫系(抗体、B細胞、T細胞など)が結合する部位のこと。抗原決定基とも呼ばれる。
【論文情報】
雑誌名:Bioorganic & Medicinal Chemistry
論文タイトル:Molecular Basis of N-Glycan Recognition by Pradimicin A and Its Potential as a SARS-CoV-2 Entry Inhibitor
著者:Yu Nakagawa (名古屋大学), Masato Fujii, Nanaka Ito, Makoto Ojika (名古屋大学), Dai Akase(広島大学), Misako Aida(広島大学), Takaaki Kinoshita(長崎大学), Yasuteru Sakurai(長崎大学), Jiro Yasuda(長崎大学), Yasuhiro Igarashi(富山県立大学), Yukishige Ito(大阪大学)
DOI: 10.1016/j.bmc.2024.117732
URL: https://www.sciencedirect.com/science/article/pii/S0968089624001469






 受験生
受験生 在学生
在学生 卒業生
卒業生 保護者等
保護者等 地域・一般
地域・一般 企業・研究者
企業・研究者 教職員
教職員